Váš košík je prázdný
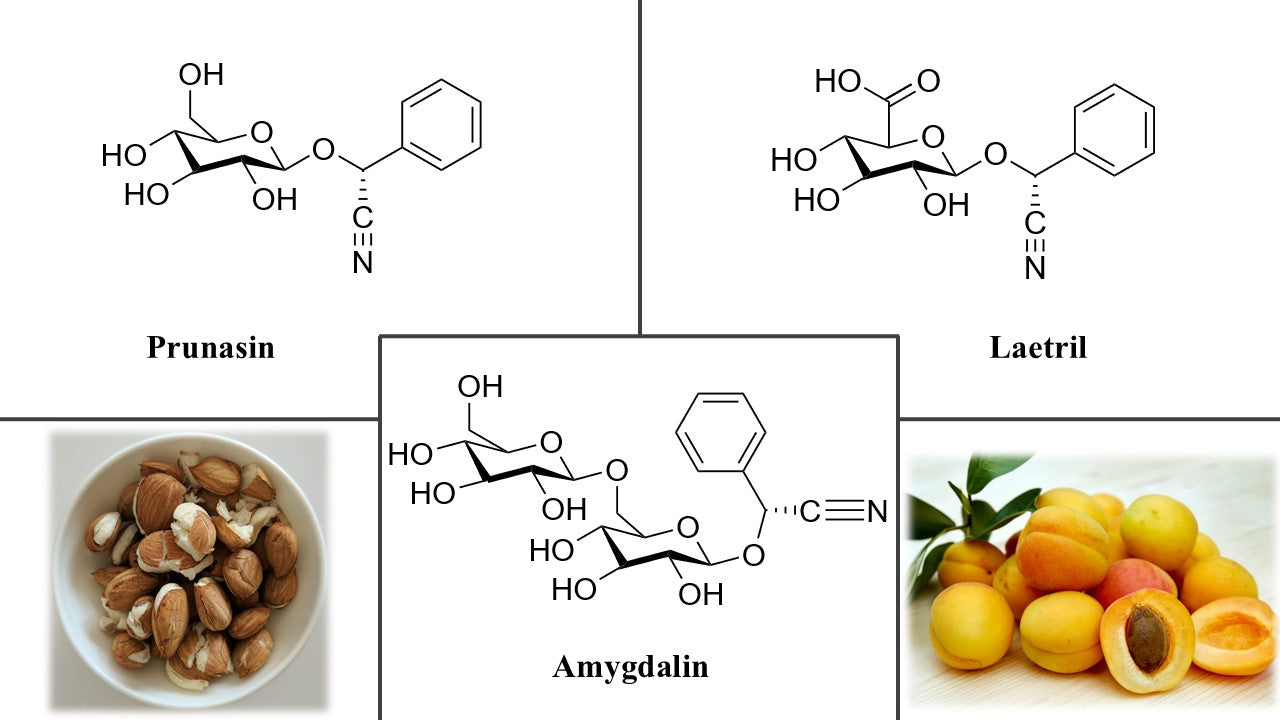
Amygdalin je přírodní kyanogenní glykosid, poprvé izolovaný v 19. století z hořkých mandlí (mandloň obecná, Prunus dulcis). Nachází se hlavně v semenech peckovin, zejména meruněk, ale také broskví, švestek, jablek či třešní (Thodberg et al., 2018). Chemicky jde o D-mandelonitril-β-D-gentiobiosid (Obr. 1). V těle se postupně hydrolyzuje na benzaldehyd, glukózu a kyanovodík (HCN) (He et al., 2020). Amygdalin bývá často zaměňován se svou polosyntetickou formou „laetrilem“ (komerční název). Laetril byl poprvé syntetizován v roce 1952 Ernstem T. Krebsem mladším, který touto modifikací (napojením jedné molekuly glukózy) chtěl zvýšit účinnost a pojmenoval ji vitamin B17 (He et al., 2020; Milazzo et al., 2015). Amygdalin a laetril byly populární v 60.–70. letech 20. století jako domnělý prostředek proti rakovině. Odhaduje se, že do roku 1978 podstoupilo léčbu laetrilem v USA asi 70 tisíc pacientů, než byl jeho dovoz úřady zakázán. V některých zemích však zůstal dostupný (např. v Mexiku či v některých státech USA pro terminálně nemocné) (Milazzo et al., 2015). V tradiční čínské medicíně jsou rozemletá hořká meruňková jádra („xing ren“) využívána po staletí, ovšem nikoli primárně proti rakovině, ale zejména k léčbě respiračních potíží. Přisuzují se jim účinky tlumící kašel a astma (expektorační a antitusické působení) a také projímavý efekt. Odvary z hořkých jader se v malých dávkách podávaly při bronchitidě, astmatu, černém kašli či zácpě. Tradiční medicína Východu tyto semena považovala za hořká a lehce toxická, proto se užívala opatrně a často po tepelné úpravě (pražení, vaření) ke snížení toxicity (Tang et al., 2024). Kromě plicních onemocnění se v etnomedicíně různých kultur objevilo použití meruňkových jader i při některých kožních neduzích, v Číně například u vitiliga či lepry, a dále při bolestech (He et al., 2020). Široce tradované tvrzení o výjimečně nízkém výskytu rakoviny u národa Hunza konzumujícího velké množství meruňkových jader bývá často zmiňováno zastánci vitaminu B17, avšak jde o neověřenou anekdotu (Petersen and Markle, 1979).
Meruňková jádra jsou bohatá na olej a bílkoviny, kromě toho obsahují právě kyanogenní glykosidy (hlavně amygdalin). Sušinu jadérek hořkých meruněk může tvořit zhruba 46–53 % tuků (olej tvořený převážně mononenasycenou olejovou kyselinou a linolovou kyselinou) a kolem 25 % bílkovin, dále asi 10 % sacharidů a vlákniny (Akhone et al., 2022). Z významných mikronutrientů jsou přítomny malé množství vitaminu E a různých polyfenolů (například chlorogenová a kávová kyselina, flavonoidy kvercetin a rutin či procyanidiny), které přispívají k antioxidační aktivitě (Akhone et al., 2022; Cheaib et al., 2018). Amygdalin sám tvoří proměnlivé procento hmoty jader v závislosti na odrůdě meruněk. V hořkých planých kultivarech může dosahovat koncentrace okolo 5 % (až cca 5,5 g na 100 g jader), zatímco ve sladkých odrůdách pěstovaných meruněk je obsah řádově nižší (desetiny procenta či méně) (Femenia et al., 1995). Analýzy uvádějí typický obsah amygdalinu v hořkých meruňkových jadérkách kolem 20–30 mg na 1 g suché hmoty (Alpaslan and Hayta, 2006). Kromě amygdalinu bývá v jádrech přítomen v menším množství i příbuzný monoglykosid prunasin (mandelonitril-β-glukosid) (Obr. 1), který je vlastně „polovinou“ molekuly amygdalinu. Při narušení buněk (např. rozkousáním jadérka) dochází působením enzymu β-glukosidázy k postupnému štěpení amygdalinu právě přes prunasin až na benzaldehyd a HCN. Benzaldehyd dodává drceným hořkým mandlím a meruňkovým jadérkům jejich typické hořkomandlové aroma (Jaszczak-Wilke et al., 2021); kyanovodík je prudce jedovatý plyn, který se však v organismu může do určité míry detoxikovat na thiokyanát (Jaszczak-Wilke et al., 2021). Kromě amygdalinu obsahují meruňková jádra i další látky, za zmínku stojí např. β-sitosterol a další fytosteroly (v olejové frakci), minerály (hořčík, fosfor, draslík, železo aj.) (Akhone et al., 2022).

Obrázek 1. Meruňka obecná (Prunus armeniaca L.) a kyanogenní glykosidy typické pro její semena.
Amygdalin proslul především proklamovanými protirakovinnými účinky, kvůli nimž se rozšířilo jeho užívání mimo oficiální medicínu. Mechanismus předpokládaného protinádorového působení spočívá v tom, že z molekuly amygdalinu se v těle uvolní kyanid, který by měl selektivně ničit nádorové buňky (Carbone et al., 2025; Jaszczak-Wilke et al., 2021). Kyanid inhibuje cytochrom c oxidázu (komplex IV) v mitochondriálním dýchacím řetězci, čímž blokuje přenos elektronů na kyslík a vede k zástavě oxidační fosforylace (tvorby ATP) (Zuhra and Szabo, 2022). Následkem je rychlý energetický kolaps buněk a jejich smrt. Tento účinek však není selektivní (Carbone et al., 2025). Kyanid poškozuje všechny buňky, ve kterých dosáhne dostatečné koncentrace, nikoli pouze buňky nádorové. Podle některých autorů mohou být nádorové buňky zranitelnější kvůli údajnému nižšímu detoxikačnímu potenciálu vůči kyanidu, například nižší aktivitě rhodanázy, a současně vyšší aktivitě β-glukosidáz, které mohou z amygdalinu uvolňovat kyanid. Tyto hypotézy však nebyly jednoznačně prokázány (Carbone et al., 2025; Greenberg, 1980; Jaszczak-Wilke et al., 2021). Přesto in vitro pokusy ukazují, že amygdalin může za určitých podmínek nádorové buňky usmrtit, typicky indukcí apoptózy (programované buněčné smrti) nebo zastavením buněčného cyklu (Spanoudaki et al., 2023). Například v některých in vitro studiích na buněčných liniích karcinomu prsu byl po expozici amygdalinu popsán nárůst poměru proapoptotického proteinu Bax k antiapoptotickému proteinu BCL-2 a zvýšení aktivity kaspázy-3, což bylo spojeno s indukcí apoptózy (Lee and Moon, 2016; Zielińska et al., 2022). Podobně byly v buněčných modelech kolorektálního karcinomu, nemalobuněčného karcinomu plic a karcinomu prostaty popsány účinky amygdalinu související s potlačením migrace a invazivity a s navozením apoptózy (Park et al., 2005; Qian et al., 2015; Spanoudaki et al., 2023). Některé práce dále naznačují snížení exprese cyklooxygenázy-2 (COX-2) a indukovatelné syntázy oxidu dusnatého (iNOS) působením amygdalinu, tyto výsledky však pocházejí převážně ze zánětlivých experimentálních modelů, nikoli přímo z nádorových buněk (Yang et al., 2007). Protizánětlivé a antifibrotické účinky amygdalinu byly popsány i mimo oblast onkologie. V experimentálních modelech plicní fibrózy a ledvinné fibrózy amygdalin zmírňoval fibrotické změny a snižoval vybrané markery fibrotizace (Guo et al., 2013; Jiao et al., 2023). Dále byly hlášeny antitusické a antiastmatické účinky, což odpovídá tradičnímu použití proti kašli a dušnosti. Tyto účinky byly ověřeny u zvířat, amygdalin snižoval frekvenci kašle a v modelech astmatu tlumil zánětlivou odpověď a remodelaci dýchacích cest (Cui et al., 2023; Miyagoshi et al., 1986). Kromě toho studie na zvířatech naznačily antiaterogenní (ochrana proti kornatění tepen) a antiulcerózní účinek, podávání amygdalinu snížilo tvorbu chemicky navozených žaludečních vředů (Abdel-Gawad et al., 2023; Wang et al., 2020). Je však třeba zdůraznit, že naprostá většina těchto poznatků pochází z laboratorních experimentů. Předklinické in vivo studie na zvířatech celkově ukazují žádný nebo jen omezený protinádorový efekt a klinické studie u lidí protinádorový účinek neprokázaly (Carbone et al., 2025; Milazzo et al., 2015). Uváděná tvrzení o úspěšné léčbě rakoviny amygdalinem vycházejí převážně z jednotlivých kazuistik (případové zprávy) bez kontrolních skupin. Takové zprávy samy o sobě neumožňují spolehlivě posoudit účinnost ani odlišit možný efekt léčby od spontánního vývoje onemocnění, souběžné terapie nebo placebo efektu. Klinické studie u lidí jsou omezené. V odborné literatuře jsou popsány dvě větší klinické studie z USA ze začátku 80. let, které hodnotily amygdalin nebo laetril u onkologických pacientů. V těchto studiích u celkem 178 pacientů nebylo prokázáno objektivní zlepšení průběhu nádorového onemocnění, nebyla pozorována regrese nádorů ani prodloužení přežití ve srovnání s očekávaným průběhem. U části pacientů byl popsán subjektivní pokles bolesti, který může souviset s doprovodnými faktory nebo s účinky některých metabolitů (Moertel et al., 1981; Moertel et al., 1982). Systematické přehledy uzavírají, že nejsou k dispozici spolehlivé důkazy o protinádorové účinnosti amygdalinu u lidí a současně je doloženo riziko závažných nežádoucích účinků (Carbone et al., 2025; Milazzo et al., 2015). V posledních letech byly publikovány nové in vitro studie zkoumající potenciální onkopreventivní působení (tj. ochranu před vznikem nádorů). V experimentálních testech byly popsány i antimutagenní nebo genoprotektivní účinky amygdalinu, tyto poznatky jsou však předběžné a vyžadují potvrzení v in vivo modelech a následně v klinickém výzkumu (Erikel et al., 2023; Todorova et al., 2017).
Odhaduje se, že dávka 0,5 až 3,5 mg kyanidu na kg tělesné hmotnosti může být pro člověka smrtelná. Evropský úřad pro bezpečnost potravin (EFSA) stanovil akutní referenční dávku (ARfD) kyanidu 20 μg ekvivalentu HCN/kg tělesné hmotnosti, což je 25krát méně než nejnižší hlášená smrtelná dávka. Pro 70kg dospělého odpovídá ARfD přibližně 1,4 mg HCN. EFSA odhaduje, že již snědení tří malých syrových meruňkových jader (cca 370 mg celkem) v jedné porci může u dospělého překročit bezpečnou hranici. U batolat může k překročení bezpečné hladiny vést i jedno malé jadérko (EFSA, 2016). Tyto odhady odpovídají hlášeným případům, v lékařské literatuře jsou popsány akutní intoxikace u dětí i dospělých po konzumaci několika meruňkových jader nebo hořkých mandlí (Jaswal et al., 2018). Příznaky otravy kyanidem zahrnují bolesti hlavy, zmatenost, návaly horka, nauzeu a zvracení, úzkost, slabost a pokles krevního tlaku, v těžších případech dušnost, křeče, bezvědomí a smrt zástavou dechu. Chronická expozice nižším dávkám může být spojena například s nespavostí, nervozitou, bolestmi kloubů a celkovou slabostí (EFSA, 2016; EFSA et al., 2019). Organismus dokáže malé množství kyanidu detoxikovat přeměnou na thiokyanát za účasti rhodanázy a dalších sulfurtransferáz, kapacita tohoto mechanismu je však omezená (Buonvino et al., 2022). Některé zdroje uvádějí, že při nedostatku síry nebo některých kofaktorů může být detoxikace pomalejší, například při výrazném deficitu vitaminu B12 nebo při užívání vysokých dávek vitaminu C (Jaswal et al., 2018). Byly popsány i případy těžkých otrav u onkologických pacientů užívajících laetril, zejména při současné konzumaci většího množství jader, někdy s nutností hospitalizace. Z těchto důvodů řada zemí prodej čistého laetrilu zakázala (Carbone et al., 2025). Doplňky stravy mají různá dávkování, často se uvádí přibližně 20 mg amygdalinu v kapsli, což zhruba odpovídá jednomu hořkému jadérku. Výrobci obvykle doporučují 1 až 2 kapsle denně, což by při dodržení dávkování a bez dalšího příjmu amygdalinu z potravy nemělo u dospělého překročit akutní referenční dávku kyanidu (EFSA, 2016; EFSA et al., 2019).
Existuje řada dalších rostlinných látek zkoumaných pro možné protinádorové nebo podpůrné účinky. Některé z nich vykazují v preklinických studiích slibné výsledky a nejsou spojeny s rizikem akutní toxicity. Je však třeba zdůraznit, že jejich použití má smysl pouze jako doplněk standardní léčby a vždy po konzultaci s ošetřujícím lékařem.
Extrakt z jmelí (Viscum album) patří v Evropě k nejčastěji využívaným postupům komplementární onkologie. Injekční přípravky se používají zejména v Německu a ve Švýcarsku především ke zlepšení kvality života. Některé klinické studie uvádějí menší výskyt nežádoucích účinků chemoterapie, lepší chuť k jídlu a úlevu od únavy. Přehledy a metaanalýzy naznačují také možný vliv na některé klinické výsledky, avšak interpretaci limitují metodické rozdíly a kvalita dostupných studií (Loef and Walach, 2020; Pelzer et al., 2022). Jmelí je obecně považováno za nízce toxické a v některých zemích je povoleno jako podpůrná léčba (PDQ Integrative and Board, 2002).
Kurkuminoidy z kurkumy (Curcuma longa) jsou intenzivně zkoumány zejména pro protizánětlivé a antioxidační působení a pro potenciální protinádorové mechanismy. V laboratorních modelech kurkumin ovlivňuje růst nádorových buněk různých typů a zasahuje do řady signalizačních drah spojených s nádorovou progresí. V některých zvířecích modelech byl popsán i efekt na zpomalení rozvoje nádorů (Akter et al., 2025; Ameer et al., 2024). Klinické studie u lidí zatím přinášejí nejednoznačné výsledky a významným omezením je nízká biologická dostupnost kurkuminu (Anand et al., 2007; Khosravi and Seifert, 2024).
Zelený čaj (Camellia sinensis) obsahuje polyfenoly, zejména epigalokatechin galát, které jsou studovány pro možné chemopreventivní účinky. V in vitro experimentech byl popsán vliv na proliferaci nádorových buněk. Epidemiologické studie, zejména z asijských populací, naznačují možnou souvislost mezi vysokou konzumací zeleného čaje a nižším výskytem některých nádorů, výsledky jsou však nekonzistentní a nelze z nich vyvozovat kauzalitu (Schulze et al., 2017; Yuan, 2013). Zelený čaj je obecně bezpečný, ve vysokých dávkách může u citlivých jedinců způsobovat nespavost a některé koncentrované extrakty mohou zatěžovat játra (EFSA et al., 2018; Grajecki et al., 2022).
Resveratrol a další antioxidanty z ovoce a zeleniny, například quercetin nebo genistein, vykazují v buněčných modelech účinky související s regulací zánětu, oxidativního stresu a buněčné signalizace včetně drah spojených s apoptózou (Huminiecki, 2022; Pawłowski et al., 2024). Jejich klinický přínos u lidí není jednoznačně prokázán, přesto probíhají klinické studie pro vybrané indikace (Joao et al., 2013; Pawłowski et al., 2024; Singh et al., 2019). Tyto látky lze zároveň přijímat běžnou stravou s nízkým rizikem a s potenciálními benefity pro kardiovaskulární zdraví (Singh et al., 2019; Weber and Hopp, 2020).
Vitamin D není rostlinný přípravek, nicméně jeho dostatečná hladina bývá spojována s celkovým zdravotním stavem a v observačních studiích i s prognózou některých onemocnění včetně vybraných nádorů (Keum et al., 2019; Manson et al., 2020; Manson et al., 2019). Suplementace u deficitních jedinců může přispět k podpoře imunitních funkcí a celkové kondice a při dodržení doporučených dávek je zpravidla bezpečná. Nelze ji však chápat jako léčbu rakoviny, spíše jako podpůrné opatření v rámci komplexní péče (Holick et al., 2011; Keum et al., 2019; Manson et al., 2019).
Pro Kratom World sepsal:
Ing. Matěj Malík, Ph.D.
Vědecký pracovník, postdoktorand
Fakulta agrobiologie, potravinových a přírodních zdrojů, ČZU
Katedra agroenvironmentální chemie a výživy rostlin

Reference

Kurkuma, známá jako „zlato orientu“, je koření i léčivka s bohatou historií v ájurvédě a tradiční medicíně. Článek podrobně popisuje její botanickou charakteristiku, chemické složení, antioxidační, protizánětlivé a další biologické účinky, možnosti dávkování i bezpečnost užívání. Nechybí ani přehled příbuzných rostlin a alternativ, které mohou účinky kurkumy vhodně doplnit.

Maca horská (Lepidium meyenii), známá také jako peruánský ženšen, je unikátní dvouletá rostlina původem z vysokohorských oblastí centrálních And. Její zdužnatělý kořen, který se vyskytuje v různých barevných variantách, je ceněn pro vysoký obsah sacharidů, bílkovin, vlákniny, vitamínů a minerálů. Tradičně byla maca klíčovou součástí stravy původních obyvatel And, kteří ji využívali nejen jako výživnou potravinu, ale i jako prostředek pro podporu vitality, plodnosti a odolnosti vůči stresu.

Ashwagandha, známá také jako vitánie snodárná (Withania somnifera (L.) Dunal), je vytrvalá bylina z čeledi lilkovitých (Solanaceae), často označovaná jako indický ženšen nebo zimní třešeň. V tradiční indické medicíně Ájurvéda se používá více než 3000 let jako „rasayana“ – omlazující prostředek podporující vitalitu, dlouhověkost a duševní pohodu. Její název „ashwagandha“ v sanskrtu znamená „vůně koně“, což symbolizuje nejen charakteristické aroma, ale i údajnou schopnost dodávat sílu a vytrvalost.